Nosokomial lungebetennelse er den vanligste og mest alvorlige nosokomiale infeksjonen, hvorav ventilatorassosiert lungebetennelse (VAP) står for 40 %. VAP forårsaket av refraktære patogener er fortsatt et vanskelig klinisk problem. I årevis har retningslinjer anbefalt en rekke tiltak (som målrettet sedasjon, hodeheving) for å forhindre VAP, men VAP forekommer hos opptil 40 % av pasienter med trakealintubasjon, noe som resulterer i lengre sykehusopphold, økt bruk av antibiotika og død. Folk er alltid på utkikk etter mer effektive forebyggende tiltak.
Ventilatorassosiert lungebetennelse (VAP) er en ny type lungebetennelse som utvikler seg 48 timer etter trakealintubasjon og er den vanligste og dødeligste nosokomiale infeksjonen på intensivavdelingen (ICU). Retningslinjene fra American Society of Infectious Diseases fra 2016 har skilt VAP fra definisjonen av sykehuservervet lungebetennelse (HAP) (HAP refererer kun til lungebetennelse som oppstår etter sykehusinnleggelse uten trakealtub og er ikke relatert til mekanisk ventilasjon; VAP er lungebetennelse etter trakealintubasjon og mekanisk ventilasjon), og European Society og Kina mener at VAP fortsatt er en spesiell type HAP [1-3].
Hos pasienter som får mekanisk ventilasjon varierer forekomsten av VAP fra 9 % til 27 %, dødeligheten er estimert til 13 %, og det kan føre til økt systemisk antibiotikabruk, langvarig mekanisk ventilasjon, lengre intensivopphold og økte kostnader [4-6]. HAP/VAP hos ikke-immunsviktige pasienter er vanligvis forårsaket av bakteriell infeksjon, og fordelingen av vanlige patogener og deres resistensegenskaper varierer med region, sykehusklasse, pasientpopulasjon og antibiotikaeksponering, og endrer seg over tid. Pseudomonas aeruginosa dominerte VAP-relaterte patogener i Europa og Amerika, mens flere Acinetobacter baumannii ble isolert på tertiære sykehus i Kina. En tredjedel til halvparten av alle VAP-relaterte dødsfall er direkte forårsaket av infeksjonen, med høyere dødelighet for tilfeller forårsaket av Pseudomonas aeruginosa og acinetobacter [7,8].
På grunn av den sterke heterogeniteten til VAP er den diagnostiske spesifisiteten til dens kliniske manifestasjoner, bildediagnostikk og laboratorietester lav, og spekteret av differensialdiagnoser er bredt, noe som gjør det vanskelig å diagnostisere VAP i tide. Samtidig utgjør bakteriell resistens en alvorlig utfordring for behandlingen av VAP. Det er anslått at risikoen for å utvikle VAP er 3 %/dag i løpet av de første 5 dagene med bruk av mekanisk ventilasjon, 2 %/dag mellom 5 og 10 dager, og 1 %/dag resten av tiden. Toppforekomsten inntreffer vanligvis etter 7 dager med ventilasjon, så det er et vindu der infeksjon kan forebygges tidlig [9,10]. Mange studier har sett på forebygging av VAP, men til tross for flere tiår med forskning og forsøk på å forhindre VAP (som å unngå intubasjon, forhindre reintubasjon, redusere sedasjon, heve hodeenden av sengen med 30° til 45°, og munnpleie), ser det ikke ut til at forekomsten har blitt mindre, og den tilhørende medisinske byrden er fortsatt svært høy.
Inhalerte antibiotika har blitt brukt til å behandle kroniske luftveisinfeksjoner siden 1940-tallet. Fordi det kan maksimere tilførselen av legemidler til målstedet for infeksjonen (dvs. luftveiene) og redusere systemiske bivirkninger, har det vist god anvendelsesverdi ved en rekke sykdommer. Inhalerte antibiotika er nå godkjent av US Food and Drug Administration (FDA) og European Medicines Agency (EMA) for bruk ved cystisk fibrose. Inhalerte antibiotika kan redusere bakteriemengden og hyppigheten av eksaserbasjoner ved bronkiektasi betydelig uten å øke de generelle bivirkningene, og nåværende retningslinjer har anerkjent dem som førstelinjebehandling for pasienter med pseudomonas aeruginosa-infeksjon og hyppige eksaserbasjoner. Inhalerte antibiotika i den perioperative perioden etter lungetransplantasjon kan også brukes som adjuvante eller profylaktiske legemidler [11,12]. Men i de amerikanske VAP-retningslinjene fra 2016 manglet ekspertene tillit til effektiviteten av adjuvante inhalerte antibiotika på grunn av mangelen på store randomiserte kontrollerte studier. Fase 3-studien (INHALE) som ble publisert i 2020, ga heller ikke positive resultater (inhalasjon av amikacin-assistert intravenøs antibiotika for gramnegativ bakteriell infeksjon forårsaket av VAP-pasienter, en dobbeltblind, randomisert, placebokontrollert fase 3-effektstudie, totalt 807 pasienter, systemisk medisinering + assistert inhalasjon av amikacin i 10 dager).
I denne sammenhengen valgte et team ledet av forskere fra det regionale universitetssykehuset i Tours (CHRU) i Frankrike en annen forskningsstrategi og gjennomførte en forskerinitiert, multisenter, dobbeltblind, randomisert kontrollert effektstudie (AMIKINHAL). Inhalert amikacin eller placebo for forebygging av VAP ble sammenlignet i 19 icus i Frankrike [13].
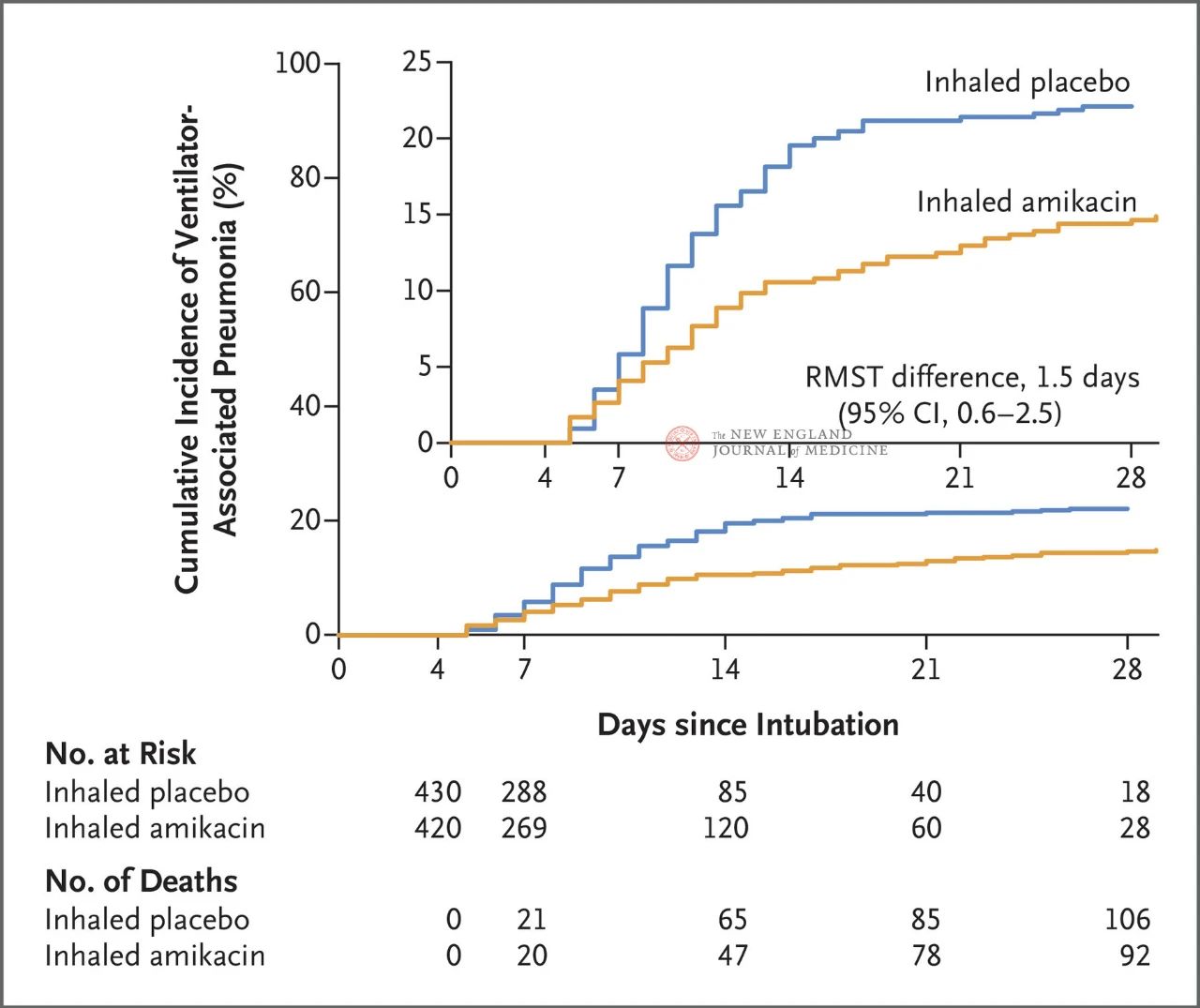
Totalt 847 voksne pasienter med invasiv mekanisk ventilasjon mellom 72 og 96 timer ble randomisert 1:1 til inhalasjon av amikacin (N = 417,20 mg/kg ideell kroppsvekt, QD) eller inhalasjon av placebo (N = 430, 0,9 % natriumkloridekvivalent) i 3 dager. Det primære endepunktet var den første episoden med invasiv mekanisk ventilasjon fra starten av den randomiserte tildelingen til dag 28.
Resultatene fra studien viste at etter 28 dager hadde 62 pasienter (15 %) i amikacingruppen utviklet VAP og 95 pasienter (22 %) i placebogruppen hadde utviklet VAP (den begrensede gjennomsnittlige overlevelsesforskjellen for VAP var 1,5 dager; 95 % KI, 0,6–2,5; P=0,004).
Når det gjelder sikkerhet, opplevde syv pasienter (1,7 %) i amikacingruppen og fire pasienter (0,9 %) i placebogruppen alvorlige bivirkninger relatert til studien. Blant de som ikke hadde akutt nyreskade ved randomisering, hadde 11 pasienter (4 %) i amikacingruppen og 24 pasienter (8 %) i placebogruppen akutt nyreskade på dag 28 (HR, 0,47; 95 % KI, 0,23–0,96).
Den kliniske studien hadde tre høydepunkter. For det første, når det gjelder studiedesign, benytter AMIKINHAL-studien seg av IASIS-studien (en randomisert, dobbeltblind, placebokontrollert, parallell fase 2-studie med 143 pasienter). For å evaluere sikkerheten og effektiviteten til amikacin-fosfomycin inhalasjonssystemisk behandling av gramnegativ bakteriell infeksjon forårsaket av inhalasjonsantibiotika (VAP) og INHALE-studien, som avsluttes med negative resultater, har erfaringer som fokuserer på forebygging av VAP oppnådd relativt gode resultater. På grunn av kjennetegnene ved høy dødelighet og langt sykehusopphold hos pasienter med mekanisk ventilasjon og VAP, vil det være mer verdifullt for klinisk praksis hvis amikacin inhalasjon kan oppnå betydelig forskjellige resultater i å redusere død og sykehusopphold hos disse pasientene. Gitt heterogeniteten i sen behandling og pleie hos hver pasient og hvert senter, er det imidlertid en rekke forvirrende faktorer som kan forstyrre studien, så det kan også være vanskelig å oppnå et positivt resultat som kan tilskrives inhalerte antibiotika. Derfor krever en vellykket klinisk studie ikke bare utmerket studiedesign, men også valg av passende primære endepunkter.
For det andre, selv om aminoglykosidantibiotika ikke anbefales som et enkeltstående legemiddel i ulike retningslinjer for inhalasjon av astma (VAP), kan aminoglykosidantibiotika dekke vanlige patogener hos VAP-pasienter (inkludert pseudomonas aeruginosa, acinetobacter, etc.), og på grunn av deres begrensede absorpsjon i lungeepitelceller, høye konsentrasjon på infeksjonsstedet og lave systemiske toksisitet. Aminoglykosidantibiotika er bredt foretrukket blant inhalerte antibiotika. Denne artikkelen er i samsvar med det omfattende estimatet av effektstørrelsen av intratrakeal administrering av gentamicin i små prøver som er publisert tidligere, noe som samlet demonstrerer effekten av inhalerte aminoglykosidantibiotika i å forhindre VAP. Det bør også bemerkes at de fleste placebokontrollene som ble valgt i studiene relatert til inhalerte antibiotika er normal saltvannsoppløsning. Men med tanke på at forstøvet inhalasjon av normal saltvann i seg selv kan spille en viss rolle i å fortynne sputum og hjelpe med slimløsende midler, kan normal saltvannsoppløsning forårsake en viss interferens i analysen av studieresultatene, noe som bør vurderes grundig i studien.
Videre er lokal tilpasning av HAP/VAP-medisinering viktig, i likhet med antibiotikaprofylakse. Samtidig, uavhengig av lengden på intubasjonstiden, er økologien på den lokale intensivavdelingen den viktigste risikofaktoren for infeksjon med multiresistente bakterier. Derfor bør den empiriske behandlingen referere til mikrobiologiske data fra lokale sykehus så mye som mulig, og kan ikke blindt referere til retningslinjene eller erfaringen fra tertiære sykehus. Samtidig er kritisk syke pasienter som trenger mekanisk ventilasjon ofte kombinert med multisystemsykdommer, og under den kombinerte påvirkningen av flere faktorer, som stresstilstand, kan det også være et fenomen med tarmmikrober som krysser med lungene. Den høye heterogeniteten av sykdommer forårsaket av intern og ekstern superposisjon avgjør også at det er en lang vei å gå for å fremme storskala klinisk markedsføring av hver nye intervensjon.
Publisert: 02. des. 2023