Kakeksi er en systemisk sykdom karakterisert av vekttap, atrofi av muskel- og fettvev og systemisk betennelse. Kakeksi er en av de viktigste komplikasjonene og dødsårsakene hos kreftpasienter. I tillegg til kreft kan kakeksi være forårsaket av en rekke kroniske, ikke-ondartede sykdommer, inkludert hjertesvikt, nyresvikt, kronisk obstruktiv lungesykdom, nevrologiske sykdommer, AIDS og revmatoid artritt. Det er anslått at forekomsten av kakeksi hos kreftpasienter kan nå 25 % til 70 %, noe som påvirker pasientenes livskvalitet (QOL) alvorlig og forverrer behandlingsrelatert toksisitet.
Effektiv intervensjon av kakeksi er av stor betydning for å forbedre livskvaliteten og prognosen til kreftpasienter. Til tross for noe fremgang i studiet av de patofysiologiske mekanismene for kakeksi, er mange legemidler utviklet basert på mulige mekanismer bare delvis effektive eller ineffektive. Det finnes for tiden ingen effektiv behandling godkjent av det amerikanske mat- og legemiddeltilsynet (FDA).
Det er mange grunner til at kliniske studier på kakeksi mislykkes, og den grunnleggende årsaken kan ligge i mangelen på grundig forståelse av mekanismen og det naturlige forløpet av kakeksi. Nylig publiserte professor Xiao Ruiping og forsker Hu Xinli fra College of Future Technology ved Peking University i fellesskap en artikkel i Nature Metabolism, som avslører den viktige rollen til laktat-GPR81-signalveien i forekomsten av kreftkakeksi, og gir en ny idé for behandling av kakeksi. Vi oppsummerer dette ved å syntetisere artikler fra Nat Metab, Science, Nat Rev Clin Oncol og andre tidsskrifter.
Vekttap skyldes vanligvis redusert matinntak og/eller økt energiforbruk. Tidligere studier har antydet at disse fysiologiske endringene i tumorassosiert kakeksi er drevet av visse cytokiner som skilles ut av tumormikromiljøet. For eksempel kan faktorer som vekstdifferensieringsfaktor 15 (GDF15), lipocalin-2 og insulinlignende protein 3 (INSL3) hemme matinntaket ved å binde seg til appetittregulerende steder i sentralnervesystemet, noe som fører til anoreksi hos pasienter. IL-6, PTHrP, aktivin A og andre faktorer driver vekttap og vevsatrofi ved å aktivere den katabolske banen og øke energiforbruket. For tiden har forskning på mekanismen for kakeksi hovedsakelig fokusert på disse utskilte proteinene, og få studier har involvert sammenhengen mellom tumormetabolitter og kakeksi. Professor Xiao Ruiping og forsker Hu Xinli har tatt en ny tilnærming for å avdekke den viktige mekanismen for tumorrelatert kakeksi fra perspektivet til tumormetabolitter.
Først screenet professor Xiao Ruipings team tusenvis av metabolitter i blodet til friske kontrollpersoner og musemodeller for lungekreftkakeksi, og fant at melkesyre var den mest signifikant forhøyede metabolitten hos mus med kakeksi. Serumnivået av melkesyre økte med tumorvekst, og viste en sterk korrelasjon med vektendringen hos tumorbærende mus. Serumprøver samlet fra lungekreftpasienter bekrefter at melkesyre også spiller en nøkkelrolle i utviklingen av kreftkakeksi hos mennesker.
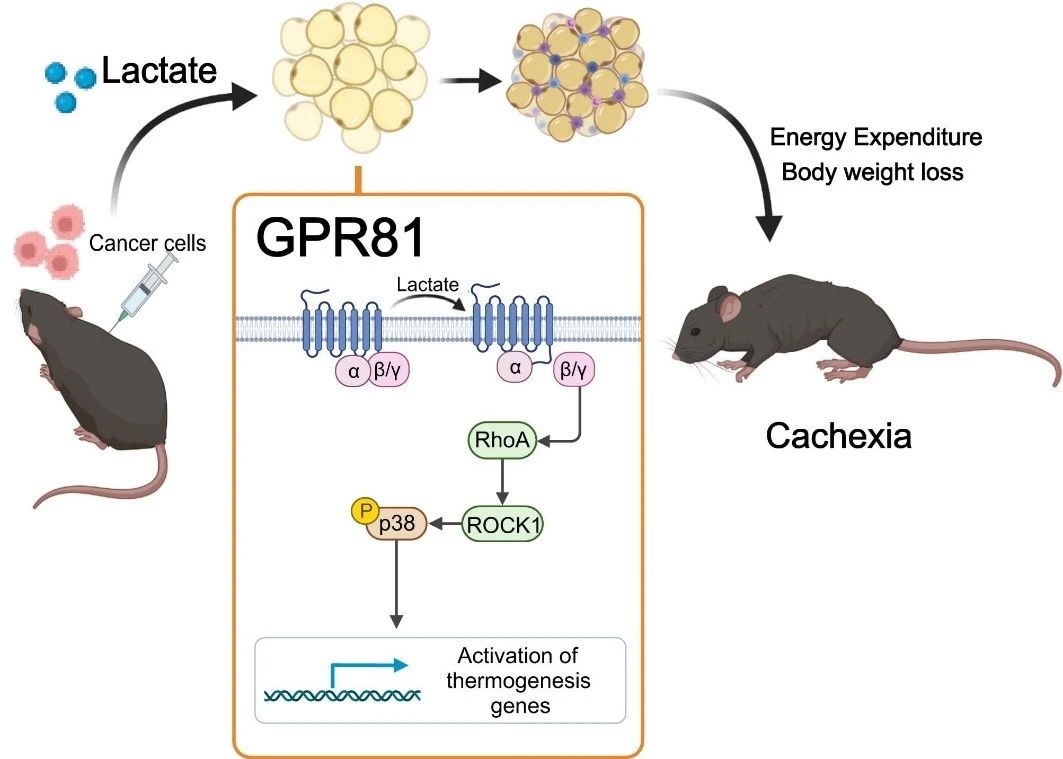
For å avgjøre om høye nivåer av melkesyre forårsaker kakeksi, tilførte forskerteamet melkesyre til blodet til friske mus gjennom en osmotisk pumpe implantert under huden, noe som kunstig økte serumnivåene av melkesyre til nivået hos mus med kakeksi. Etter to uker utviklet musene en typisk fenotype av kakeksi, som vekttap, fett- og muskelvevsatrofi. Disse resultatene tyder på at laktatindusert fettombygging ligner på den som induseres av kreftceller. Laktat er ikke bare en karakteristisk metabolitt av kreftkakeksi, men også en viktig mediator av kreftindusert hyperkatabolsk fenotype.
Deretter fant de at sletting av laktatreseptoren GPR81 var effektiv i å lindre tumor- og serumlaktatinduserte kakeksi-manifestasjoner uten å påvirke serumlaktatnivåene. Fordi GPR81 er høyt uttrykt i fettvev og endrer seg i fettvev tidligere enn skjelettmuskulatur under utviklingen av kakeksi, er den spesifikke knockout-effekten av GPR81 i musefettvev lik den ved systemisk knockout, noe som forbedrer tumorindusert vekttap og fett- og skjelettmuskulaturforbruk. Dette antyder at GPR81 i fettvev er nødvendig for utvikling av kreftkakeksi drevet av melkesyre.
Ytterligere studier bekreftet at etter binding til GPR81 driver melkesyremolekyler fettbruning, lipolyse og økt systemisk varmeproduksjon gjennom signalveien Gβγ-RhoA/ROCK1-p38, snarere enn den klassiske PKA-veien.
Til tross for lovende resultater i patogenesen av kreftrelatert kakeksi, har disse funnene ennå ikke blitt oversatt til effektive behandlinger, så det finnes for øyeblikket ingen behandlingsstandarder for disse pasientene, men noen foreninger, som ESMO og European Society of Clinical Nutrition and Metabolism, har utviklet kliniske retningslinjer. For tiden anbefaler internasjonale retningslinjer sterkt å fremme metabolisme og redusere katabolisme gjennom tilnærminger som ernæring, trening og medisinering.
Publisert: 28. april 2024